Colostrum unterstützt Therapie und Rehabilitation
Helfer in schweren Zeiten (Krebstherapie)
Krebs ist die Krankheit, vor der sich Menschen am meisten fürchten. Die Diagnose stürzt viele Betroffene in eine schwere Krise – selbst wenn die Heilungschancen nach medizinischem Ermessen teilweise recht hoch sind. Die Therapie geht an den Rand der psychischen und körperlichen elastbarkeit. Da läßt es aufhorchen, wenn Mediziner von einer Substanz berichten, welche die Nebenwirkungen spürbar reduziert und die Wirksamkeit der eigentlichen Behandlung steigert: Das Mittel heißt Colostrum.
Colostrum auch Biestmilch genannt, enthält Abwehrstoffe (Immunglobuline), Wachstumsfaktoren, Vitamine, Spurenelemente und viele weitere wirksamen Inhaltsstoffe.
"Colostrum ist eine Enzymbombe", urteilt Dr. med. Heinrich Ollendiek aus Bad Nau-heim. Er hat sich unter anderem intensiv mit der Hyperthermiebehandlung von Tumorpatienten beschäftigt. Sie wird begleitend zu Chemotherapie oder Bestrahlungen eingesetzt. Der große Nachteil aller Krebstherapien: Sie sind für den Patienten sehr anstrengend und schwächen sein Immunsystem. Hier hilft Colostrum. Es stärkt den gesamten Organismus und: "Es scheint, daß Colostrum die Reaktionsbereitschaft fördert", formuliert Dr. Ollendiek bewußt vorsichtig.
Diese Erfahrungen bestätigt der Allgemeinmediziner Dr. Georg Beer aus Eggenfelden. In einem weiteren Punkt sind sich beide Ärzte, die völlig unabhängig voneinander arbeiten, einig: "Am Besten wäre es, wenn man mit Colostrum schon vor der eigentlichen Therapie beginnt", erklärt Dr. Beer. Colostrum steigert die Abwehrkräfte und die Leistungsfähigkeit, es verbessert die Darmflora und lässt Entzündungen und Verletzungen schneller heilen. Alles zusammen hilft wohl dem Patienten, die schwere Tumortherapie besser zu bewältigen. Dr. Ollenndiek versucht, die großen Möglichkeiten, die das Colostrum birgt, "therapeutisch so weit wie möglich auszunutzen". Eine große Rolle ordnet er dem Stoff auch in der Geriatrie zu. Der 70jährige arbeitet täglich noch in seiner Praxis.
Rindercolostrum kann Hilfe für AIDS-Patienten bedeuten
Rindercolostrum wird seit Ewigkeiten als ein Nahrungsmittel, das die Immunität steigert, angewendet, aber neuere wissenschaftliche Forschung des Lancet, der Kinderärzte, der Immunologie und des Journals of Medical Microbiology haben sogar noch größere Vorteile, besonders für die AIDS/HIV-betroffene Gemeinschaft gezeigt. Menschen mit AIDS oder HIV fallen Darmbakterien zum Opfer, die chronische Diarrhöe, Verlust von Nährstoff-Aufnahme und schließlich das vollständige Versagen des Immunsystems verursachen. Rindercolostrum könnte die Antwort sein, um diese opportunistischen Bakterien aufzuhalten.
Colostrum ist ein nährstoffreicher Milch-Vorläufer, der Immunglobuline, Wachstumsfaktoren, antimikrobische Proteine und Kohlenhydrate enthält, die Immunität von der Mutterkuh in das gastro-intestinale System des Kalbes unmittelbar nach der Geburt transportieren. Die Mutter produziert für ungefähr 36 Stunden nach der Geburt Colostrum, das frei von Milch, Laktose, Lactalbumin und anderen Allergie-verursachenden Inhaltsstoffen ist. Mütterliche Immunfaktoren können die Plazenta in den Blutkreislauf des Neugeborenen passieren, aber diese Faktoren können in den gastro-intestinalen Trakt nicht eindringen außer via direktem Kontakt mit Colostrum.
Es gibt viele Hinweise, dass aufbereitetes Colostrum als Nahrungsergänzung eine sichere, effektive und natürliche Methode ist, um Diarrhöe in Menschen und Tieren zu kontrollieren. Im Gegensatz zu frei verkäuflichen und verschreibungspflichtigen Arzneimitteln, wie z.B. Antibiotika, potentiell giftige Neuro-Pharmakologicas und kolloidalem Bismuth (ein Schwermetall), ist Colostrum eine gut dokumentierte und drogenfreie nährstoffreiche Alternative, um Diarrhöe in den Griff zu bekommen. Dies ist äußerst verheißungsvoll für AIDS-Patienten, die oft von Diarrhöe heimgesucht werden, die von Cryptosporidien- Rotavirus und infektiösen Darmgrippen verursacht werden. Sämtliche Darmpathogene werden von Colostrum gut in den Griff bekommen. (Übers. d. Mai 96-Ausgabe des Delicious!Magazins/Ad)
Abschrift aus : Naturheilpraxis mit Naturmedizin: Sonderdruck aus 10/98 51. Jahrgang,Nr. 10/Oktober 1998 Seiten 1650-1651
Die Behandlung der Multiplen Sklerose mit Colostrum- compositum-Suppositorien
Die Multiple Sklerose (MS) wird erst seit jüngerer Zeit als Autoimmunerkrankung erkannt. Über die auslösenden Faktoren dieser Immunstörung ist nichts Sicheres bekannt. Man vermutet, dass Virusinfektionen dabei eine Rolle spielen.
Die Deutung der MS als eine Autoimmunerkrankung führte folgerichtig zu Behandlungsversuchen mit Substanzen, die das Immunsystem beeinflussen können. Hierbei seien in erster Linie die verschiedenen Formen des Interferons genannt. Leider haben diese Therapieansätze die in sie gesetzten Hoffnungen nicht erfüllen können. So kann man mit Interferonpräparaten zwar die schubförmige Form der Multiplen Sklerose etwas beeinflussen, die chronisch-progrediente Form jedoch ist dieser Therapie nicht zugängig. Wir versuchten daher einen anderen Weg unter Anwendung von Thymusextrakten, die rektal appliziert wurden. Diese Applikation schont die empfindlichen Wirksubstanzen am besten, wobei die rektale Resorption erfahrungsgemäß auch sehr gut ist.
Bei der Anwendung von diesen Thymus Extrakt-Suppositorien trat aber ein Problem auf, die Erstverschlimmerung. Diese stellte nicht nur ein medizinisches, sondern auch ein großes psychologisches Problem für den Patienten dar. Auch ließ die Wirksamkeit zu wünschen übrig, so dass wir nach einer Verbesserung suchten. Durch Zugabe von Gehirnextrakten konnten wir die Wirksamkeit deutlich steigern. Ein Problem auch dieses kombinierten Thymus-Extraktes bestand aber darin, dass die verwendeten Organe von Kälbern stammten, deren Herkunft zu dieser Zeit nicht einwandfrei verfolgt werden konnte und somit die Möglichkeit einer BSE-Infizierung diskutiert werden musste.
Daher versuchten wir es mit einer anderen immunologisch sehr wirksamen Substanz, dem Colostrum von Rindern. Dieses Colostrum konnte ich von einer sorgfältig kontrollierten Herde beziehen und damit die Auflagen des Arzneimittelinstitutes erfüllen. Das Colostrum wird gefriergetrocknet und rektal in Form von Suppositorien verabreicht. Die rektale Anwendung schien auch hier die beste zu sein, weil so die empfindlichen Inhaltssubstanzen am wenigsten angegriffen werden.
Bei der Beurteilung der Effektivität muss man beachten, dass die MS in zwei Verlaufsformen auftritt. Erstens gibt es die schubförmige, zweitens die chronischprogrediente Verlaufsform. Bei der schubförmigen Form kommt es häufig ohne einen erkennbaren Grund zu einer deutlichen Verschlechterung des Zustandes, die sich in vielen Fällen aber fast völlig wieder zurückbilden kann, ohne dass man dieses immer auf eine Therapie zurückführen müsste. So ist es bei der schubförmigen Verlaufsform äußerst schwierig zu sagen, ob eine Besserung des Zustandes spontan eingetreten ist oder auf eine Therapie zurückgeführt werden kann.
Um diese Frage zu klären, braucht man daher große Statistiken. Anders verhält sich die Situation bei der chronisch-progredienten Form der MS. Hier schreitet die Krankheit mehr oder weniger langsam und kontinuierlich fort. Spontane Besserungen sind äußerst selten.
Wenn es also bei dieser Verlaufsform unter einer speziellen Behandlung gehäuft zu Stillstand oder gar Besserung des Krankheitsbildes kommt, kann man dieses auch in einer kleineren Statistik auf die Behandlung zurückführen. Ein zweites Problem ist die exakte Diagnose. Diese kann in den meisten Fällen nur nach einer längeren fachkundigen Beobachtung gestellt werden. Ich bin daher Prof. Mazur, Direktor der Neurologischen Universitätsklinik in Bydgoszcz/Polen, sehr zu Dank verpflichtet, dass er aufgrund meiner Beobachtungen bereit war, die Wirksamkeit der Colostrum-compositum-Suppositorien bei MS-Patienten der chronisch-progredienten Form nachzuprüfen. Wir gingen davon aus, dass ein neues Präparat so gut sein sollte, dass es auch bei der chronisch-progredienten Form der MS deutlich positive Ergebnisse bringt. Außerdem sollte es möglichst wenige negative Nebenwirkungen hervorrufen. Diese beiden Forderungen werden von Colostrum-comp.-Suppositorien voll erfüllt. Sie rufen keine Erstverschlimmerung hervor, wie wir das bei den Thymus-Extrakt-Suppositorien gesehen haben, und die im folgenden zu beschreibenden Ergebnisse kann man schon als sensationell bezeichnen, und ich glaube, dass sie durch eine höhere Dosierung noch weiter verbessert werden können.
Da mein eigenes Patientengut die Voraussetzungen einer exakten Zuordnung zur schubförmigen bzw. chronisch-progredienten Form der MS nicht erfüllt, möchte ich daher im folgenden nur die Ergebnisse von Dr. Mazur anführen.
- Bei 3 Patienten trat eine leichte Besserung des Zustandes ein. Es trat bisher keine Progredienz mehr ein.
- Bei 3 Patienten trat keine deutliche Besserung des Zustandes ein, aber es trat auch keine Progredienz ein.
- Bei einem Patienten wurde die Krankheit von der chronisch-progredienten Form in die leichter zu behandelnde schubförmige Form überführt.
- Bei 2 Patienten konnte keine positive Wirkung auf die Erkrankung festgestellt werden. Der Zustand verschlechterte sich weiter so, wie man es normalerweise erwarten konnte.
Aus diesem Grund ist es ein maximales Therapieergebnis, wenn der Krankheitsverlauf zum Stillstand gebracht und eine wenn auch nur leichte Verbesserung des Zustandes erreicht werden kann.
Die Colostrum-comp.-Suppositorien wirken auch therapeutisch bei der Hypertonie und beim Diabetes. Insbesondere verstärken sie die Wirkung von Antihypertonika und Antidiabetika. Vor Beginn einer Behandlung mit Colostrum-comp.-Supp. muss man daher abklären, ob der zu behandelnde Patient diese erwähnten Präparate bekommt. Es ist dann zweckmäßig, deren Dosierung auf etwa die Hälfte zu reduzieren und nach etwa 2 Wochen den erforderlichen Bedarf neu einzustellen. Auf den normalen Blutzucker hat dieses Präparat keinen Einfluss.
Anschrift der Verfasser:
Prof. Dr. Roman Mazur / Direktor der Neurologischen Universitätsklinik / PL-85-094 Bydgoszcz/Polen
Grand Rounds at the Clinical Center of the National Institutes of Health
Saul Rosen, Ph.D, MD, Section Editor
Transforming Growth Factor-β Vielfache Wirkungen und potentielle klinische Applikationen
(Michael B. Sporn, MD, Anita B. Roberts, PhD)
Embryogenese
Moderne Studien mit Peptid - Wachstumsfaktoren zeigen die molekulare Bestätigung der alten Idee, dass die Reparatur von Gewebeverletzungen eine Wiederholung des embryotischen Prozesses darstellt. Immunhistochemische und in-situ-Kreuzungs-Studien haben gezeigt, dass TGF-β eine wichtige morphogenetische Substanz im Säugetierembryo, besonders während der Neubildung ist, die während der Entstehung der Wirbelsäule, der Extremitäten, der Zähne, Gesichtsknochen und der Herzklappen auftritt. Hohe Mengen von TGF-β werden normalerweise in embryonischen Strukturen gefunden, die potentielle Gefahrenstellen für angeborene Missbildungen sind, wie der Gaumen oder das intraventrikuläre Septum des Herzens. Die Bildung und Umbildung von Bindegewebe, die während normaler Embryogenese stattfindet, beinhaltet biochemische Mechanismen, die denen während der Reparatur von Verletzungen beim Erwachsenen ähnlich sind und es scheint, dass TGF-β ein wichtiger Vermittler beider Prozesse ist.
Entzündung und Reparatur
Inzwischen gibt es ausführliche Literatur über die Rolle des TGF-β während Entzündungen und Reparatur. Blutblättchen sind die konzentrierteste Quelle von TGF-β im Körper. TGF-β wird von ihren Alpha-Körnchen an den Stellen der Gewebeverletzungen abgesondert, wodurch eine Vielzahl von Reparaturprozessen gestartet wird. TGF-β ist der potenteste bekannte chemotaktische Faktor für Makrophagen und bereits schon im Picogramm-Stadium aktiv. Er zieht Makrophagen an die Stelle der Gewebeverletzungen, aktiviert deren Synthese von anderen Wachstumsfaktoren und deaktiviert die Produktion von hydrogenen Peroxiden, die die entstehenden Fibroblasten zerstören würden. TGF-β besitzt auch wichtige chemotaktische und anabole Wirkungen auf Fibroblasten, die an der Zellreparatur beteiligt sind. Es stimuliert ihre Produktion von kritischen Bestandteilen der extrazellulären Matrix, wie Collagen, Fibronectin (sowie deren Rezeptoren, die als „Integrine“ bekannt sind) und Proteoglykane und verhindert die Wirkung von proteolytischen Enzymen, die neu gebildetes Bindegewebe zerstören. Das Resultat dieses Mechanismus ist die Bildung von neuem Granulationsgewebe an der Wirkungsstelle von TGF-β. Dies konnte experimentell an Tieren beobachtet werden, denen man subkutan TGF-βinjizierte; an der Injektionsstelle bildete sich schnell eine Beule von stark gefäßdurchzogenem Granulationsgewebe (24 - 48 Stunden), das langsam verschwand, als die Injektionen gestoppt wurden. TGF-β hat auch gezeigt, dass es die Gen-Übertragung auf Collagen fördert.
Dieses Molekül spielt eine wichtige Rolle in der Bildung der Strukturstärke bei der Wundheilung und übernimmt einen essentiell wichtigen Part in der Matrix von Knochen und Knorpeln.
Diese Wirkungen sind offensichtlich relevant für viele potentielle klinische Anwendungen, z.B. bei der Heilung von Operationswunden oder bei Patienten, die sich einer Chemotherapie unterziehen müssen; ferner bei der Behandlung von Diabetes, Dekubitus und varikosen Geschwüren sowie der Behandlung von Verbrennungen. Studien haben gezeigt, dass TGF-β bei Tieren die Wundheilung beschleunigen kann. Eine wichtige neue Anwendung war die intraokulare Anwendung von TGF-βnach einer Ablösung der Retina im Kaninchenauge. TGF-β förderte die retinale Wiederanbindung zum darbunterliegenden Choroid. Weitere klinische Studien sind geplant.
Wie aus klinischen oder tierischen Studien an pulmonarer Fibrose, hepatitischer Cirrhose, Skleroderma, Keloiden, proliferativer Vitreoretinopathie und rheumatischer Arthritis hervorgeht, gibt es Erkrankungsstadien, in denen exzessive Produktion von TGF-β oder abnormale Sensitivität von Zielzellen auf seine Wirkung zur Pathogenese von Fibrose beitragen können. Bei den zwei letztgenannten Erkrankungen wurden bedeutend höhere Konzentrationen von TGF-β in okularen oder synovialen Absonderungen der Patienten festgestellt. In jenen mit proliferativer Vitreoretinopathie korrespondierte die TGF-β - Konzentration mit der Ernsthaftigkeit der Erkrankung.
Knochen und Knorpel
Zur Zeit besteht intensives Interesse daran, welche Rolle verschiedene peptide Wachstumsfaktoren bei der Bildung von Knochen und Knorpel spielen, mit dem Ziel, solche Stoffe zu benutzen, um die Reparatur von verletztem Gewebe zu beschleunigen oder Osteoporose zu stoppen. Chondrogenese und Osteogenese sind komplexe, vielschrittigen Prozesse, die verschiedene Zelltypen und vielzählige peptide Vermittler einbinden, die untereinander in verwickelten Rückkoppelungs-Schlingen interagieren. Es ist wahrscheinlich, dass zukünftig jeglicher wirksamer klinischer Gebrauch von peptiden Wachstumsfaktoren zur Stimulation der Knochen- oder Knorpelbildung, den kombinierten oder teilweisen Gebrauch von verschiedensten Faktoren, die als ein Set agieren, voraussetzt. TGF-β ist einer der entscheidenden peptiden Wachstumsfaktoren, die auf Chondrozyten oder Osteozyten wirken. Er ist in die embryotische Bildung von Knochen und Knorpel involviert und ist in den Wachstums-Plättchen von langen Knochen vorhanden. Hohe Konzentrationen werden auch in den Knochen von Erwachsenen gefunden. In der Tat wurde die zweite Form dieses Peptids, TGF-β 2, ursprünglich aus ausgewachsenen Rinderknochen isoliert. TGF-β ist ein potenter Beschleuniger des Typ-2-Collagens und der Proteoglykane, die die außerzelluläre Matrix formen.
Die physiologische Rolle des TGF-β in den Knochen Erwachsener ist noch unbekannt. Es wird vermutet, dass TGF-β die strikte Kopplung des Prozesses der Knochenresorption und neuer Knochenbildung steuert, die für die ständige Neubildung charakteristisch ist, die in normalen Knochen von Erwachsenen stattfindet, und dass die Wirkungen von Vitamin D und des parathyroiden Hormons bei der Neubildung durch ihre Wirkung auf das TGF-β vermittelt werden. Die Wirkung von Estradiol, das Knochengewebe zu vermehren, kann durch die Fähigkeit des Östrogen-Rezeptors, das Gen für TGF-β zu aktivieren, vermittelt sein und somit die Bildung von neuer Knochen-Matrix fördern.
Derzeit sind in vielen Labors Studien im Gang, um festzustellen, ob TGF-β zur beschleunigten Heilung von Knochenbrüchen eingesetzt werden kann, da es einerseits als Mitogen für Osteoblasten fungiert und zum anderen auch als ein Stimulans für deren Produktion von extrazellulärem Gewebe gilt. Im Knochenkallus heilender Brüche wurden erhöhte Werte von Boten-RNA für TGF-β gefunden, sowie das Peptid selbst (M. Bolander, MD,S. Jingushi, MD und M. Joyce, MD, oral communication, Mai 1989); darüber hinaus steigert die in-vivo - Injektion von TGF-β die Knochenbildung bei Ratten. Zwei neue Proteine, bekannt als Knochen-morphogenetische Proteine, wurden charakterisiert und geklont und dabei als entfernte Mitglieder der erweiterten TGF-β-Gen-Familie identifiziert. Es wird erwogen, Knochen-morphogenetische Proteine zu nutzen, um die Bildung von Knochen zu beschleunigen; dabei wird es sehr bedeutend sein, festzustellen, ob sie synergistisch mit TGF-β agieren.
Über die Rolle von TGF-β in der Pathogenese von Knochenerkrankungen ist sehr wenig bekannt. Die neuesten Informationen über den Einfluss von Östrogen bei der Stimulierung von TGF-β, werden Grundlage für weitere Studien über seine Wirkung bei Osteoporose sein. Ein verwandtes Problem ist der Gebrauch von Tamoxifen als ein präventives oder adjuvantes Agenz in der Behandlung von Brustkrebs. Obwohl Tamoxifen oft als „Antiöstrogen“ angesehen wird, scheinen viele seiner Wirkungen unabhängig vom Östrogen-Rezeptor zu sein. In klinischen Studien wurde bewiesen, dass es Knochenmasse weniger ansteigen lässt, als vielmehr erhält. Tamoxifen ist ein potentes Stimulanz der TGF- β-Sekretion und es ist möglich, dass die Erhaltung der Knochenmasse durch diese Wirkung hervorgerufen wird. Die obengenannten Resultate deuten alle darauf hin, dass die Entwicklung neuer pharmakologischer Substanzen, die die Bildung von TGF-β in Knochen steigern, eine neue therapeutische Annäherung zur Behandlung von Osteoporose bedeuten.
Unterdrückung von lymphozytären Funktionen
TGF-β ist der potenteste bekannte endogene Hemmer von lymphozytärer Proliferation und Funktion; er ist 10 000 bis 100 000 mal stärker (auf molarer Basis) als Cyclosporin. Er ist ein endogenes Produkt von T- und B-Zellen, das als autokrines Stop-Signal fungiert, indem es die Wirkung der Interleukine und anderer Cytokine (wie Tumor Nekrose Faktor, TNF), die lymphozytäre Funktionen stimulieren, unterdrückt. Daher verhindert TGF-β die Proliferation von T-Zellen, die durch Interleukin 1 oder 2 stimuliert werden, unterbindet die Proliferation und Antikörper Produktion in B-Zellen, die von verschiedenen aktivierenden Faktoren stimuliert wurden, unterdrückt die cytolytische Aktivität von natürlichen Killer- Zellen und verhindert die Zeugung von cytotoxischen T-Zellen und lymphokin-aktivierten Killer-Zellen. Ganz sicher benötigt das Immunsystem seinen eigenen Mechanismus, um die exzessive Proliferation und Wirkung einzudämmen, wenn diese von Antigenen stimuliert wurden und es scheint, dass TGF-β hier eine Hauptrolle spielt.
Die obengenannten Wirkungen wurden in einer Reihe von invitro- Studien mehrfach bestätigt und bilden die Basis für neue Versuche, TGF-β in-vivo als ein immunsuppressives Agenz zu benutzen. Diese Studien befinden sich z.Zt in ihren frühesten Stadien, aber es wurden Fortschritte gemacht und zwar in erster Linie bei der Unterdrückung von Abwehrreaktionen nach Herzverpflanzungen. Systemische Gaben von rekombinantem TGF-β an Empfängermäusen hat die Akzeptanz verpflanzter Herzen bedeutend verbessert. (R. Morris, MD und M. Palladino, PhD, oral communication, June 1989). Der Gebrauch von TGF-β in experimentellen Verpflanzungen von Leber, Pankreas-Inseln und Nieren wird derzeit ebenfalls intensiv getestet.
Ein anderes Gebiet derzeitiger Studien ist der Gebrauch von TGF-β, um entzündliche Prozesse zu unterdrücken, die von aktivierten T-Zellen ausgehen, wie es bei verschiedenen Typen experimenteller Arthritis der Fall ist, sowie bei klinischer rheumatischer Erkrankung.
Klinische Daten weisen bereits darauf hin, dass hohe Konzentrationen von TGF-β immunsuppressiv sind. Der immununterdrückende Status gewisser Krebs-Patienten, am meisten die mit Glioblastomen, könnte das Resultat einer Sekretion von hohen TGF-β-Konzentrationen aus den Tumoren sein; wenn diese bösartigen Knoten operativ entfernt wurden, kehrte die normale Immun-Funktion zurück. In der Tat hat man TGF-β zum ersten Mal aus einer Glioblastom-Zelllinie isoliert. Es wurde zuerst durch seine Fähigkeit, die TZellen Funktion zu unterdrücken, charakterisiert. Die Möglichkeit, dass exogene immununterdrückende Agenzien, wie Cyclosporin oder Dexamethanoson, die TGF-β Synthese in Lymphozyten stimulieren könnten, wird derzeit untersucht. Einige der toxischen Manifestionen von Cyclosporin, insbesondere seine Fähigkeit, renale Fibrose zu induzieren, könnten ebenfalls mit einer Induktion von TGF-β zusammenhängen.
TGF-β im Herzen
Immunhistochemische Untersuchungen an Ratten und Mäusen haben kürzlich ungewöhnlich große Mengen von intrazellulärem TGF-β in Herzmyozyten, Herzganglien und den leitenden Zellen des atrioventrikulären Knotens gezeigt. Die physiologische Rolle des TGF-β bei normaler Herzfunktion ist unbekannt. Wir haben erst kürzlich das TGF-β1 in Rattenherzen während eines myokardialen Infarktes, der durch eine Ligation der linken Herzarterie verursache wurde, untersucht. Ansteigender Verlust von TGF-β in den Myozyten fand innerhalb 1 Stunde nach der Ligation statt, jedoch fand man 24 - 48 Stunden später steigende Konzentration in den Myozyten der infarktbetroffenen Stellen. Die Analyse der TGF-β1 Boten-RNA in infarktbetroffenen Herzen zeigte zusätzlich das Auftreten einer neuen molekularen Spezies (ein 1.9 kilobase Transkript), zusammen mit einem bemerkenswerten Anstieg in dem üblichen 2.4-kilobase Trankskript, das man in den meisten Geweben findet. Die Bedeutung dieser Veränderungen des TGF-β im infarktbetroffenen Herzen ist unbekannt und es sind weitere Untersuchungen vonnöten, um seine Rolle in der Pathogenese und der Reparatur von Herzverletzungen zu untersuchen. Die Möglichkeit, dass exogenes TGF-β, das an die Stellen der infarktbetroffenen Verletzungen appliziert wird, die Heilung beschleunigen könnte, muss nun in Betracht gezogen werden, besonders im Hinblick auf die bekannte Fähigkeit des TGF-β‘s, andere Arten der Wundheilung zu fördern. Da sich die Beweise häufen, dass Veränderungen in der extrazellulären Collagen-Matrix des Herzens mit pathologischen Prozessen, wie Hypertrophie und Ischämie in Zusammenhang stehen, wird es sehr wichtig sein, die Rolle des TGF-β bei diesen Konditionen zu testen.

TGF-β und Karzinogenese
Während des Prozesses der Karzinogenese könnten Epithelzellen, deren Teilung normalerweise durch TGF-β unterdrückt ist, dem autokrinen oder parakrinen Wachstum durch TGF-β entkommen und autonom werden. Die Mechanismen sind bisher noch nicht vollständig verstanden, könnten aber einen Verlust von TGF-β selbst, einen Verlust des TGF-β-Rezeptors in der putativen Tumorzelle oder auch eine Fehlfunktion im intrazellulären Wachstumskontrollpfad, der von TGF-β gesteuert wird, bedeuten. Alle Mechanismen, die aus dem Verlust solch negativer Wachstumskontrolle resultieren, könnten mit einer gesteigerten Empfänglichkeit von bösartigen Tumoren einhergehen. Die Entwicklung pharmakologischer Agenzien, die die TGF-β Sekretion in Vorstadien bösartiger Epithel-Tumore steigern, bevor diese ihre Sensitivität auf TGF-β verlieren, bieten neue Methoden der Chemoprävention von bösartigen Tumoren. Wie bereits zuvor bemerkt, ist Tamoxifen ein solches Agenz und neuere Erkenntnisse deuten darauf hin, dass retinale Säure und ihre Analoge (Retinoide) ebenfalls durch Mechanismen, die TGF-β involvieren, gesteuert werden. (A. Glick, PhD und S. Yuspa, MD, oral communication, June 1989). Sowohl Tamoxifen als auch Retinoide wurden erfolgreich zur Verhinderung von Brust- oder Hautkrebs in experimentellen Tierversuchen eingesetzt und befinden sich derzeit in klinischen Studien an Patienten mit hohem Risiko zur Verhinderung von bösartigen Tumoren.
The New England Journal of Medicine
Schutz durch Milch-Immunglobulin-Konzentrat bei oraler Administration mit
enterotoxischen Escherichia Coli Bakterien
Carol O. Tacket, M.D., Genevieve Losonskiy, M.D., Harriet Link, B.Sc., Yen Hoang, Pierre Guesry, M.D., Helmut Hilpert, Ph.D., and Myron M. Levine, M.D., D.T.P.H.
Name Immunglobulin Immunglobulin Immunglo Immunglobulin
G M A E
Abkürzung IgG IgM IgA IgE
Antwort des Antwort des Immunsystems Antikörperfunktion Immunsystems bei
Immunsystems bei Infektion bei Infektion. Sekretorisches IgA ist Parasitenbefall.
Vermittelt Reaktion bei überwiegender
exogen allergischer Antikörper der Sekrete Vermittelt Reaktion bei
Alveolitis (Typ III - Allergie) (z.B. Tränen, Speichel) Allergie vom Soforttyp
Schleimhäute
Methoden
Milch - Immunglobulin - Konzentrat Bereitung
Freiwilligen Studie
Das klinische Protokoll wurde vom Humanitären, Freiwilligen Forschungskommitee der Universität genehmigt. Zwanzig gesunde erwachsene Freiwillige wurden in die Isolationsabteilung des Universitätskrankenhauses eingewiesen. Zehn wurden durch eine zufällige Auswahl gewählt, um das Immunglobulin-Konzentrat gegen enterotoxines E.Coli und die 10 anderen, um das Immunglobulin Konzentrat gegen Rotaviren zu erhalten. Die Auswahl wurde getroffen, indem jeder Freiwillige angehalten wurde, ein gefaltetes Papier aus einer Kiste zu wählen, das kodiert war, um seine Behandlung anzuzeigen. Beide Behandlungs-Produkte wurden in identische Einzelverpackungen gegeben; beide, sowohl die Behandelnden als auch die Freiwilligen waren während der gesamten Studie und auch in der folgenden Auswertung nicht unterrichtet, wer welche Behandlung erhielt. Jeder der Freiwilligen konsumierte 3.55 g des Immunglobulin Konzentrates und des Antazids, das in 237 ml Wasser aufgelöst war, drei mal täglich, 15 Minuten nach jedem Mal für insgesamt 7 Tage. Zwei Stunden nach der siebten Dosis (am dritten Tag der Prophylaxe) wurden die Freiwilligen einer Behandlung mit enterotoxigenem E.Coli Stamm H10407 (078:H11) unterzogen, welches hitzebeständiges Enterotoxin, hitze-unbeständiges Enterotoxin und CFA I produziert. Eine Minute nachdem die Freiwilligen 118 ml Wasser, das 2 g Sodium Bikarbonat enthielt getrunken hatten, tranken sie 1,2 x 109 Kolonienformende Einheiten E.Coli, die in 30 ml Wasser, das Sodium Bikarbonat enthielt, aufgelöst waren. Fünfzehn Minuten später nahmen sie noch eine Dosis des Immunglobulin Konzentrates.
Bevor sie aus dem Krankenhaus entlassen wurden, erhielten die Freiwilligen eine fünftägige Behandlung mit Neomycin um das pathogene E.Coli vollständig zu eliminieren. Eine Diarrhöe wurde als flüssiger Stuhl von 300 ml oder mehr definiert oder zumindest zwei flüssige Stühle die insgesamt 200 ml oder mehr innerhalb von 48 Stunden ausmachten. Nur wässriger Stuhlgang wurde ausgeschieden bevor die Behandlung mit Neomycin als Teil der
Analyse begonnen wurde.
Bakteriologie und Serologie
Täglich wurde Stuhl zur Kultur eingesammelt. E.Coli H10407 wurde identifiziert, indem 10 Kolonien von jedem Freiwilligen für Agglutination mit Anti-078 und Anti-CFA I Serum getestet wurden. Serummuster waren vor Beginn der Studie,am 8., 21., und 28. Tag gezogen worden um die Tests für Serologie, Blutbild und die Bestimmung der hepatitischen Transaminasen zu bestimmen.
Anti-CFA I
Serum Konzentrationen des IgG gegen CFA I wurden durch enzymatischen Immunoassay (ELISA) bestimmt. Immulon-I Platten wurden mit 5μg CFA I pro Milliliter beschichtet, gewaschen, mit Phosphat-gebufferter Salzlösung und 5% fötales Kälberserum blockiert und wieder gewaschen. Test Serummuster wurden von einem Titer von 1:25 auf einen Titer von 1:3200 in den Vertiefungen verdünnt und die Platten wurden gewaschen. Ziegen Antihumanes IgG das an alkaline Phosphatase gebunden war, die auf einen Titer von 1:600 verdünnt wurde, wurde hinzugefügt und die Platten wurden inkubiert und gewaschen. Die Reaktion wurde mit Phosphatase Substrat (Kirkegaard und Perry) in Gang gesetzt und in einem ELISA Reader Spectrophotometer gelesen. Serokonversion wurde als ein Anstieg des Titers auf vierfache Menge oder mehr definiert.
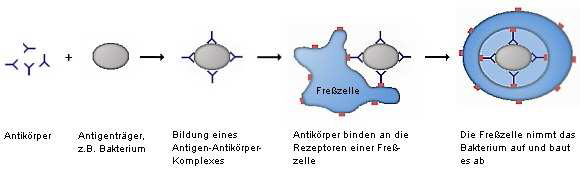
Anti-hitze-unbeständige Enterotoxine
Die Serumkonzentrationen des IgG gegen hitze-unbeständige Enterotoxine wurden ebenfalls mit ELISA gemessen. Die Platten wurden mit 1.0 μg gereinigtem Enterotoxin pro Milliliter (Schweizer Seruminstitut) beschichtet. Die Bestimmung wurde wie oben beschrieben durchgeführt, aber nur mit einer Verdünnung des Serums (Titer, 1:100). Serokonversion wurde als ein Anstieg in optischer Dichte von 0,2 oder mehr definiert.
Anti-078 LPS
Serum Konzentrationen des IgG und IgA gegen 078 LPS wurden mit ELISA gemessen. Die Platten wurden mit 50 μg 078 LPS pro Milliliter, das vom E.Coli Stamm H10407 gewonnen wurde, beschichtet. Die Bestimmung wurde wie oben beschrieben für Anti-CFA I durchgeführt, aber die Serummuster wurden zweifach von 1:25 auf 1:800 verdünnt und beide antihumane IgG und IgA Verbindungen wurden verwendet. Serokonversion wurde als ein Anstieg im Titer von 4-facher Menge oder mehr definiert.
Ergebnisse
Klinische
Neun der zehn Freiwilligen, die Immunglobulin-Konzentrat gegen Rotavirus (Kontrolle) erhalten hatten und keiner der 10 Freiwilligen, die das Immunglobulin-Konzentrat gegen enterotoxisches E.Coli erhielten, hatten nach Administration von E.Coli (Fisher's genauer Test P<0.0001) Diarrhöe.. Die 10. Kontrolle hatte zwei wässrige Stuhlgänge, Magersucht, Erbrechen, Krämpfe und Fieber; jedoch war die gesamte Stuhlmenge vor der Behandlung mit Neomycin lediglich 182 ml, das nicht die Definition einer Diarrhöe erreichte. Das durchschnittliche Stuhlvolumen der Freiwilligen mit Diarrhöe war 1522 ml (Bereich 337 bis 4578). Die Teilnehmer der Kontrollgruppe mit Immunglobulin-Konzentrat hatten auch andere Symptome einschließlich Magersucht (neun Freiwillige), Fieber (neun), Krämpfe (acht) und Erbrechen (sechs). Die durchschnittliche Inkubationszeit betrug 48,2 Stunden. Keiner der Teilnehmer der Immunglobulin Konzentrat Gruppe gegen E.Coli hatte diese Symptome.
Keine Nebenwirkungen von dem Immunglobulin-Konzentrates wurden an einem Freiwilligen beobachtet. Jedoch wurden moderate Erhöhungen in Serum Konzentrationen der hepatischen Transaminasen in sieben Freiwilligen beobachtet, davon fünf aus der Immunglobulin-Konzentration-Gruppe gegen E. Coli und zwei aus der Kontrollgruppe gegen Rotavirus. Am 9. Tag der Behandlung war das höchste Maß des Serum Aspartet Aminotransferase mit 96 Einheiten pro Milliliter (normal sind 15 - 55) und die maximale Höhe der Alanin Aminotransferase mit 138 Einheiten pro Milliliter (normal sind 5 - 56) erreicht. Alle Transaminasenwerte war innerhalb von vier Wochen wieder normal.
Bakteriologie
Alle 20 Freiwilligen schieden E. Coli H10407 im Stuhl aus. Zur Zeit der maximalen Ausscheidung der Bakterien schieden die Teilnehmer der Immunoglobulin-Konzentrat Gruppe gegen E. Coli im Durchschnitt 1.1 x 109 H10407 Organismen pro Gramm Stuhl aus, wobei die Teilnehmer der Kontrollgruppe gegen Rotavirus 9.8 x 10 Organismen pro Gramm Stuhl ausschieden. Die Neomycin - Behandlung wurde am 2 oder 3. Tag nach der oralen Administration von E. Coli bei 6 Freiwilligen begonnen, die wegen ihrer Erkrankung frühere Behandlung benötigten und am 4. Tag nach der Administration bei den anderen 14 Freiwilligen. Die Freiwilligen in beiden Gruppen schieden H 10407 die selbe Anzahl von Tagen aus (Durchschnitt 7.2 Tage bei den Teilnehmer der Immunglobulin Konzentrat Gruppe gegen E. Coli und 7.8 Tage in der Kontrollgruppe gegen Rotavirus).
Serologie
Vier der 10 Teilnehmer der Immunglobulin-Konzentrat-Gruppe gegen Rotavirus (40 Prozent) und einer der 10 Teilnehmer der enterotoxische E. Coli Gruppe (10 Prozent) hatten vierfachen Anstieg in Serum Konzentrationen des IgG gegen CFA I (P nicht bedeutend im Vergleich zu den Serokonversionsraten in beiden Gruppen) (Tabelle 1).Jedoch war der maximale geometrisch durchschnittliche titer des Anti-CFA I höher in der Kontrollgruppe als unter der Gruppe gegen E. Coli (Tabelle 1). Die Rate der Serokonversion und der maximale geometrische Durchschnittstiter des Anti-078 war ebenfalls höher in der Kontrollgruppe (Tabelle 1). die Serokonversionsrate gegen hitze-unbeständige Enterotoxine war jedoch in beiden Gruppen gleich.
Diskussion
Das Milch-Immunglobulin-Konzentrat mit hohen Mengen an Antikörpern gegen enterotoxisches E. Coli Antigens lieferte wirkungsvollen Schutz gegen orale Administration mit 1.2 x 109 E. Coli H10407. Keine Nebenwirkungen wurden auf das Rinderimmunglobulin beobachtet. Gelegentliche Erhöhungen in Serum Konzentrationen von hepatischen Transaminasen wurden in Freiwilligen, die in unserem Krankenhaus untergebracht waren, beobachtet, könnten aber auch ihrer hoch-eiweißhaltigen Kost zugeschrieben werden. Die Gabe des Immunglobulin-Konzentrates 15 Minuten nach der Administration von E. Coli optimieren ganz unzweifelhaft die Möglichkeit für passive Immunisierung. Obwohl einige der Organismen bereits im Magen durch die Gabe des Immunglobulin Konzentrates, das sofort nach der Administration verabreicht wurde, neutralisiert hätten werden können, wissen wir, dass die Bakterien in den Darm passierten, da alle Freiwilligen positive Stuhl Kulturen hatten und ungefähr die Hälfte von Ihnen Immunreaktionen auf enterotoxisches E Coli Antigen hatten. Die Produktion von Antikörpern auf die Administration der Bakterien weist darauf hin, dass die Organismen die Antigen-produzierenden Zellen des Darms erreicht hatten. Ob das Immunglobulin-Konzentrat sofort nach Kontakt (z.B. im Falle eines Reisenden nach einem potentiell verseuchten Mahl) konsumiert werden muss oder ob eine weniger häufige Anwendung genauso wirksam wäre ist nicht bekannt. Die schützende Wirkung des Immunglobulin Konzentrates gegen Stämme des enterotoxischen E.Coli, die andere 0-, H- und Kolonisierung Faktor Antigene entwickeln, ist ebenso unbekannt. Das Immunglobulin-Konzentrat enthielt hohe Mengen an Antikörpern gegen wichtige Antigene des administrierten Stammes, inklusive Anti-078, Anti-CFA I und Anti-hitzeunbeständige Enterotoxine. Diese Studie hat gezeigt, dass Antigen-Antikörper Interaktionen, die im Darm oder der Darmschleimhaut stattfinden schützend sind. Diese Interaktionen könnten die Anzahl der Bakterien zu einer Konzentration vermindert haben, die nicht ausreicht, um Diarrhöe hervorzurufen. Da jedoch die Stuhl-Kulturen bei allen Freiwilligen positiv waren, war der Mechanismus des Schutzes nicht rein bakteriell, ein Phänomen, das in vorangegangenen Studien bereits beobachtet wurde. Vorangegangene Studien lassen vermuten, dass Antikolonisationsfaktor Immunität und nicht antitoxische Immunität der Schutzfaktor sind. Passive Immunglobulin Behandlung verhindert die Entwicklung von Antikörpern gegen CFA I und 078 Antigenen. Die höchsten Titer gegen diese Antigene waren niedriger bei den Teilnehmern der Immunglobulin Konzentrat Gruppe gegen E. Coli als in der Kontrollgruppe. Nichtsdestotrotz zeigten 40 Prozent der Teilnehmer der Anti-E.Coli Gruppe wesentliche Anstiege der Immunglobuline (sie hatten keine Diarrhöe) IgG Titer gegen hitzeunbeständige Enterotoxine und 078 und auffällige IgA Titer stellten sich ebenso ein. Diese Antikörper könnten zu dem Schutz gegen zukünftige Diarrhöen bei Kontakt mit enterotoxischem E. Coli beitragen. Daher liefert das bovine Immunglobulin-Konzentrat passive Immunität und erlaubt die Entwicklung aktiver Immunität bis zu einem bestimmten Grad nach Infektion mit enterotoxischem E. Coli. Rindermilch-Immunglobulin widersteht der Proteolyse und behält spezifische Antikörper Aktivität nach Passage durch den gastrointestinalen Trakt von Neugeborenen bei. Diese Studie hat gezeigt, dass wenn ein Antacid nach den Mahlzeiten gegeben wird, das Rinder-Immunglobulin auch der Proteolyse und der Inaktivierung von Magensäure in Erwachsenen widersteht. Diese vorläufigen Resultate sind höchst vielversprechend und garantieren die Einführung von weiteren Studien, um das Spektrum der Aktivität, Dosierung und die Durchführbarkeit von Milch-Immunglobulin-Konzentrat als ein prophylaktisches Mittel gegen die Fernreise Diarrhöe durch enterotoxische E. Coli weiter zu untersuchen.